类风湿性关节炎(RA)是一种以关节滑膜异常增生、关节组织破坏为病理特征的慢性自身免疫性疾病。传统治疗药物如非甾体抗炎药、改善病情抗风湿药及糖皮质激素等主要通过抗炎及非特异性免疫抑制来暂时缓解疼痛和炎症,但长期高剂量使用常伴有严重的副作用,且无法从根本上纠正异常的免疫反应。因此,开发一种安全高效的RA免疫疗法是国际风湿病学领域亟待解决的关键问题。
诱导免疫耐受以重建RA免疫稳态被认为是极具前景的治疗策略。该策略旨在通过应用RA相关自身抗原,诱导抗原特异性免疫耐受,从而终止异常的自身免疫应答。免疫耐受成功建立的关键标志包括:调节性T细胞(Treg)和B细胞(Breg)扩增,Th1与17细胞分化及增殖及促炎细胞因子的产生抑制;最终实现免疫平衡的重建。
2025年3月,广东医科大学药学院彭新生教授和新加坡国立大学李博文研究员等合作在《Acta Biomaterialia》(中科院1区Top期刊,影响因子9.4)发表题为“Immuno-engineered macrophage membrane-coated nanodrug to restore immune balance for rheumatoid arthritis treatment”的研究论文。该研究成功开发了一种新型免疫工程化的纳米药物(MP@NEs/CT),通过联合递送多表位瓜氨酸化自身抗原(CitP)和免疫调节剂雷公藤甲素(TPL),成功实现了抗原特异性免疫耐受的诱导,实现RA的有效治疗。具体而言,干扰素γ处理的巨噬细胞膜上调PD-L1表达,修饰纳米乳后能与炎症关节中的PD-1结合,实现纳米药物的主动靶向递送;CitP能诱导抗原特异性的免疫耐受,从而抑制异常的免疫反应,与低剂量的TPL联合应用能显著增强Treg和Breg比例,并抑制Th1和Th17细胞的分化,最终恢复免疫平衡。在胶原诱导型关节炎小鼠模型中,MP@NEs/CT治疗显著减轻了关节肿胀和临床评分,并抑制了骨质侵蚀和软骨破坏。

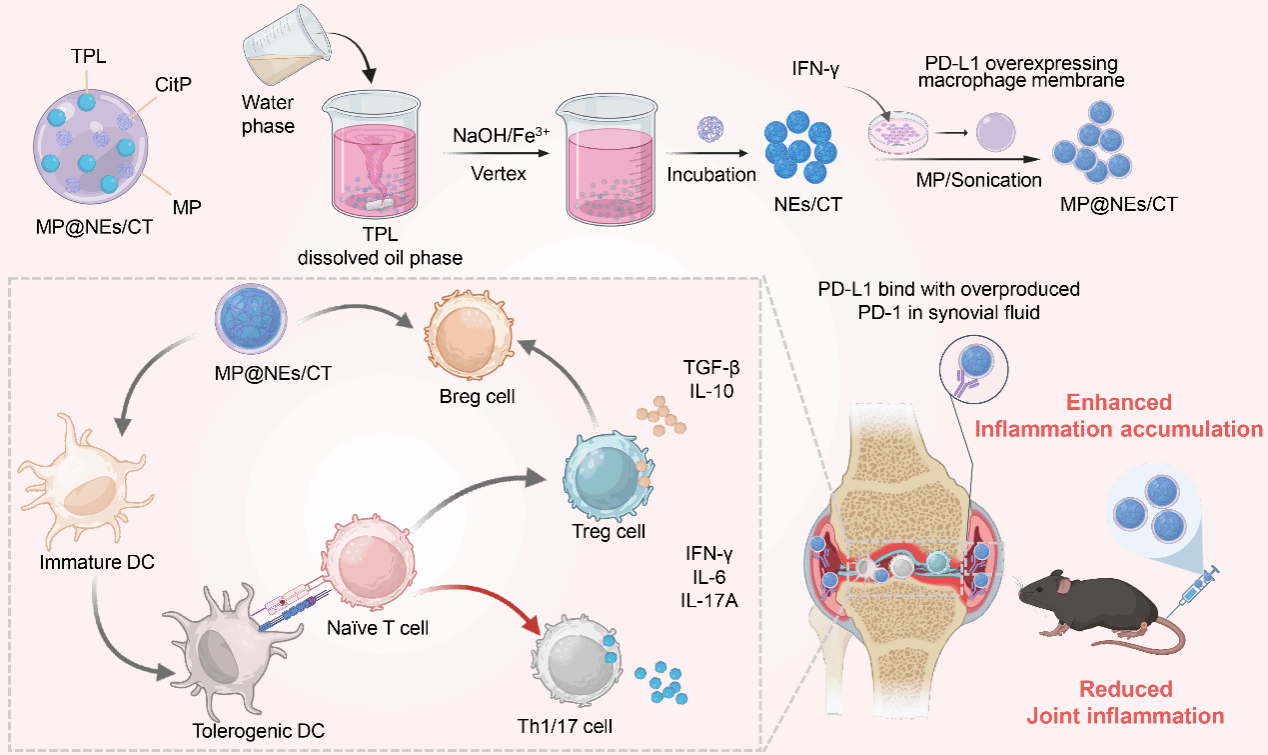
图1.作用机制
广东医科大学药学院钟小芳博士为本文第一作者。广东医科大学药学院彭新生教授和新加坡国立大学李博文研究员为本文通讯作者。本研究工作既体现了药学院在高层次人才培养体系构建和支持,同时也表明了药学院积极探索和推进与国际知名学术机构的紧密合作。(文、图/彭新生)
全文链接:https://doi.org/10.1016/j.actbio.2025.03.023

